
   |
|
КНИГИ ПО ХИМИИ: |
|
АММОНИЙ БРОМИСТЫЙ (АММОНИЙ БРОМИД)
NH4Br Мол. в. 97,95
Свойства
Бесцветные кристаллы в форме призм. Пл. 2,40 г/см3. Препарат устойчив на свету и на воздухе лишь в чистом состоянии. При нагревании разлагается. Хорошо растворим в воде, мало растворим в этиловом спирте. Приготовление Препарат реактивной чистоты можно получить из аммиака и брома:
8NH4OH + 3Br2 = 6NH4Br + N2б + 8H2O
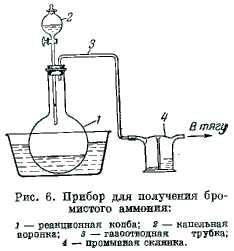 В круглодонную колбу 1 (рис. 6) емкостью 2 л, помещенную в бак с холодной водой и снабженную капельной воронкой 2 и отводной трубкой 3, наливают 570-580 мл 20%-ного NH4OH (ч.). Трубку 3 соединяют с промывной склянкой 4, наполненной водой, и из капельной воронки начинают медленно прикапывать (под тягой) бром (350 г). Попадание в раствор каждой капли брома сопровождается шипением, причем колба наполняется туманом бромистого аммония, часть которого вместе с аммиаком увлекается выделяющимся азотом в промывную склянку.
По окончании приливания брома жидкость должна иметь сильнощелочную реакцию, в противном случае добавляют еще NH4OH. Избыток брома недопустим, так как при этом образуется взрывчатый бромистый азот. Содержимое промывной склянки переливают в реакционную колбу и оставляют раствор на 2-3 суток. Если при этом образуются кристаллы, то их растворяют, прибавляя немного воды. Надо следить за тем, чтобы жидкость была прозрачна и содержала избыточный аммиак (должен ощущаться запах аммиака). Реакционный раствор выдерживают для того, чтобы полностью разложился образующийся в некотором количестве комплекс*1 брома с бромистым аммонием. Реакцию считают законченной, когда проба раствора при подкислении H2SO4 перестанет окрашиваться в желтый цвет. Раствор фильтруют, упаривают на водяной бане до тех пор, пока над слоем выпавших кристаллов останется лишь немного жидкости, и охлаждают. Кристаллы отсасывают на воронке Бюхнера.
*1Этот комплекс разрушается аммиаком, но только медленно.
| |


