
   |
|
КНИГИ ПО ХИМИИ: |
|
АНГИДРИД СЕРНИСТЫЙ (СЕРА ДВУОКИСЬ)
SO2 Мол. в. 64,06
Свойства
Бесцветный газ с характерным удушливым запахом. При нормальных условиях 1 л газа весит 2,9266 г; пл. 2,2638 (по воздуху).
Сернистый ангидрид легко сгущается в бесцветную легкоподвижную жидкость с пл. 1,4911 г/см3 при -20 °С, т. кип. -10 °С. Испарение жидкого SO2 сопровождается сильным охлаждением (до -57 °С, а под вакуумом до -68 °С). Может быть получен твердый сернистый ангидрид в виде белых хлопьев, плавящихся при -72,7 ± 0,05 °С.
SO2 хорошо растворяется в воде с образованием сернистой кислоты H2SO3. Насыщенный водный раствор при 0 °С содержит 18,60%, при 20 °С - 10,14% SO2. Раствор сернистой кислоты представляет собой бесцветную жидкость с сильным запахом SO2. Это кислота средней силы, ее константы диссоциации: K1 = 1,7·10-2, K2 = 6,2·10-8 при 25 °С. На воздухе, постепенно окисляясь кислородом, сернистая кислота переходит в серную.
Сернистый ангидрид хорошо растворяется также в органических жидкостях (этиловом спирте, диэтиловом эфире, сероуглероде). При растворении в камфоре в отношении 300:1 по объему образуется жидкий раствор.
SO2 не горюч и не поддерживает горения. Обладает сильными белящими свойствами. Приготовление газообразного SO2 Работу следует проводить под тягой.
1. Сернистый ангидрид можно получить действием концентрированной серной кислоты на медь при нагревании:
Cu + 2H2SO4 = CuSO4 + SO2б + H2O
В круглодонную колбу, снабженную газоотводной трубкой и капельной воронкой с H2SO4 (пл. 1,84), загружают 100 г медных стружек и 55 мл H2SO4 (пл. 1,84) и смесь нагревают. Когда начинается бурная реакция, нагревание прекращают и осторожно по каплям, регулируя скорость выделения газа, прибавляют из воронки еще 55-70 мл H2SO4.
Выделяющийся газ промывают водой и сушат, пропуская его через колонку с прокаленным CaCl2.
2. Удобнее получать SO2 действием кислот на соли сернистой кислоты например на сернокислый:
Na2SO3 + H2SO4 = Na2SO4 + SO2б + H2O
В колбу, содержащую насыщенный раствор Na2SO3 (или твердый пиросульфит натрия Na2S2O5), приливают по каплям H2SO4 (пл. 1,84). Выделяющийся газ сушат, пропуская его через трубку с прокаленным CaCl2 и склянку с H2SO4. Приготовление жидкого SO2 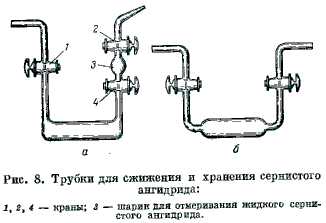 Полученный по одному из описанных выше методов газообразный SO2 дополнительно осушают, пропуская через две последовательно соединенные промывные склянки с конц. H2SO4, и затем вводят для сжижения в толстостенные стеклянные трубки (рис. 8), охлаждаемые смесью льда и хлористого натрия.
В этих же трубках жидкий SO2 можно хранить при комнатной температуре.
Для того чтобы вылить из трубки (рис. 8, а) некоторое количество жидкости, поступают следующим образом, открывают кран 4 (краны 1 и 2 закрыты) и переливают немного жидкости в шарик 3. Затем закрывают кран 4, ставят прибор вертикально и, открыв кран 2, выпускают из шарика воздух. Далее закрывают кран 2, снова открывают кран 4 и наклоняют прибор так, чтобы шарик 3 весь наполнился жидким SO2, после чего кран 4 закрывают. Отмеренную таким образом жидкость выливают из прибора, открыв кран 2.
Если пользуются трубкой другой конструкции (рис. 8, б), то при выливании жидкости через один кран, другой кран также должен быть открыт. Иначе под давлением паров SO2 из сосуда будет выброшено все содержимое. Приготовление твердого SO2 1. Жидкий SO2 испаряют в вакууме (под колоколом воздушного насоса), при этом часть SO2 затвердевает.
2. Сосуд с жидким SO2 охлаждают смесью твердой CO2 с диэтиловым эфиром. Приготовление раствора сернистой кислоты. Дистиллированную воду насыщают газообразным SO2.
| |


