
   |
|
КНИГИ ПО ХИМИИ: |
|
ВАНАДИЙ ПЯТИОКИСЬ (ВАНАДИЕВЫЙ АНГИДРИД)
V2O5 Мол. в. 181,88
Свойства
Оранжевый кристаллический порошок или красно-коричневатые кристаллы в форме игл, пл. 3,357 г/см3. Т. пл. 670 °С. Выше 700 °С реактив разлагается на VO2 и O2. В воде растворим очень мало (0,07% при 25 °С). Приготовление 1. Пятиокись ванадия можно получить путем термического разложения ванадата аммония:
2NH4VO3 = V2O5 + 2NH3б + H2Oб
В фарфоровой чашке нагревают до 350-400 °С 131 г NH4VO3 (ч. д. а.) при частом энергичном перемешивании никелевым шпателем. Сначала масса чернеет вследствие образования VO2, а после прокаливания в течение 1 ч черная окраска постепенно переходит в красную, характерную для V2O5. Прокаливание продолжают еще 1-2 ч, после чего отбирают пробу для определения полноты окисления V2O4. Для этого 1 г препарата растворяют в 10 мл 30%-ного раствора щелочи, при этом не должно получаться черного остатка. Если имеется черный остаток, то препарат растирают в ступке и прокаливают еще 20 мин, после чего снова проверяют полноту окисления.
Выход 100 г. Полученный препарат обычно соответствует реактиву квалификации ч. д. а.
Еще лучше проводить разложение высушенного при 250 °С NH4VO3 в вакууме при остаточном давлении 2-5 мм. рт. ст. и 550 °С в течение 2-3 ч. Получается крупнозернистый препарат, не содержащий летучих примесей*1.
2. Для получения V2O5 реактивной квалификации из технического продукта рекомендуется высокотемпературное хлорирование*2. Образующуюся хлорокись ванадия переводят в ванадат аммония и, далее в V2O5:
V2O5 + 3C + 6Cl2 = 2VOCl3б + 3COCl2
2VCl3 + 8NH4OH = 2NH4VO3в + 6NH4Cl + 4H2O
2NH4VO3 = V2O5 + 2NH3б + H2Oб
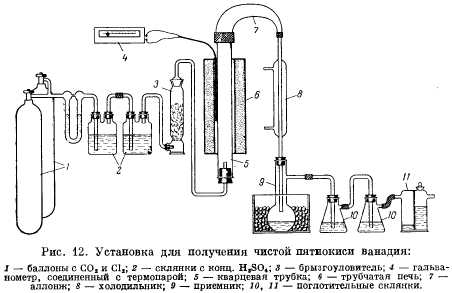 Затем брикеты переносят в вертикально установленную кварцевую трубку 5 (рис. 12), обогреваемую печью 6 и соединенную аллонжем 7 с холодильником 8 и приемником 9. Вытеснив воздух из аппарата двуокисью углерода из баллона 1, брикеты нагревают в токе СО2 2 ч при 150 °С для удаления сорбированной влаги. Затем повышают температуру до 300-350 °С и пропускают через трубку 5 ток хлора из другого баллона (расход 30 л/ч). Начало хлорирования замечается по образованию желтых паров хлорокиси ванадия VOCl3, конденсирующихся в приемнике 9. Пары VOCl3, не успевшие сконденсироваться в приемнике, улавливаются в поглотительных склянках 10 и 11 с раствором NaOH. При навеске брикетов в 100 г хлорирование заканчивается через 50-60 мин.
После прекращения выделения паров VOCl3 полученную хлорокись ванадия перегоняют с дефлегматором и холодильником (т. кип. 126,7 °С) для отделения твердых частиц унесенных примесей, оставляя в перегонной колбе в качестве кубового остатка 2-5% первоначального количества жидкости. Затем VOCl3 гидролизуют водой и обрабатывают 20%-ным NH4OH, взятым в избытке. Жидкость вместе с выпавшими кристаллами упаривают досуха и остаток прокаливают при 500-600 °С.
Выход чистого препарата около 86%. Содержание примесей: SiO2 - 0,02%, Fe2O3 - 0,002%, Al2O3 - 0,0005%, TiO2 < 0,005%, Sb2O3 ≤ 0,0005%.
*1Вулих А. И., Кутолин С. А. Информ. бюл. Промышленность химических реактивов, М., изд. ИРЕА, 1965, т. 1, № 7, с. 55.
*2Винаров И.В., Янкелевич Р. Г., Укрхим. ж., 1964, т. 30, № 5, с. 524.
*3При отсутствии каменноугольного пека можно смешать пятиокись ванадия с порошком древесного угля и патокой, смесь высушить при 120 °С и прокалить без доступа воздуха (Шека И. А., Янкелевич Р. Г. Укр. хим. ж., 1967, т. 33, № 10, с. 1011, 1040).
| |


