
   |
|
КНИГИ ПО ХИМИИ: |
|
АММИАК
NH3 Мол. в. 17,03
Свойства
Бесцветный газ с сильным характерным запахом (с совершенно чистом виде обладает острым запахом, мало похожим на обычный запах аммиака). При нормальных условиях 1 л аммиака весит 0,7708 г. Плотность по воздуху 0,5962. Т. пл. -77,8, т. кип. -33,4 °С. При комнатной температуре аммиак может быть переведен в жидкое состояние при давлении 6-7 бар. Пл. жидкого аммиака при 0 °С равна 0,638 г/см3.
В атмосфере кислорода аммиак горит зеленоватым пламенем, образуя азот и воду. Смесь 4 объемов NH4 и 3 объемов O2 сильно взрывается при зажигании. Аммиак очень хорошо растворяется в воде с большим выделением тепла, хорошо растворяется в этиловом спирте и других спиртах.
Водный раствор аммиака (водный аммиак, гидрат окиси аммония, гидроокись аммония, нашатырный спирт) представляет собой бесцветную жидкость легче воды с характерным запахом аммиака. Имеет сильнощелочную реакцию. Константа диссоциации NH4OH 1,76·10-5 при 25 °С. При нагревании до кипения весь аммиак выделяется из раствора в виде газа.
Раствор NH3 ведет себя во многих отношениях, как раствор гидрата окиси аммония NH4OH, но попытки получить это соединение в чистом виде при обычной температуре не увенчались успехом. Однако исследование кривой плавкости системы NH3 - H2O указало на существование при низких температурах соединений 2NH3·H2O [или (NH4)2O] - окиси аммония с т. пл. -78,9 °С и NH3·H2O (или NH4OH) - гидроокиси аммония с т. пл. -79 °С, кристаллизующихся в бесцветных кристаллах.
Работы последних лет показали, что NH3 в воде находится не в виде NH4OH, а в виде гидрата NH3·H2O*1. Приготовление газообразного аммиака. 1. Газообразный NH3 удобнее всего получать из технического концентрированного водного аммиака путем медленного нагревания. При этом получается ровная сильная струя газа.
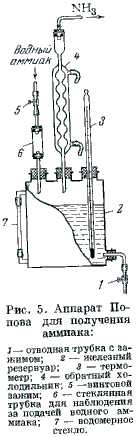 Аппарат*2 для получения большого количества NH3 изображен на рис. 5. Железный резервуар 2 делают из куска трубы (высота 11 см и диаметр 9 см), к которой приваривают дно и верхнюю крышку с тремя горловинами. В горловины вставляют термометр 3, доходящий почти до дна резервуара, обратный холодильник 4 и стеклянную трубку 6, служащую для наблюдения за скоростью подачи водного аммиака из бутыли (на рисунке не показана). Скорость подачи водного аммиака регулируют винтовым зажимом 5. Сбоку аппарат должен иметь водомерное стекло 7, а внизу отвод, снабженный зажимом 1.
Резервуар наполовину заполняют водой и нагревают до 98 °С. Открывая зажим 5, прибавляют по каплям водный аммиак так, чтобы NH3 выделялся из аппарата с требуемой скоростью. Зажим 1 при этом приоткрывают настолько, чтобы уровень жидкости в резервуаре оставался постоянным. Выделяющийся аммиак пропускают через склянку Тищенко с дистиллированной водой и затем осушают в колонке с твердым KOH.
Отрегулированный прибор может работать часами, причем в вытекающей жидкости остается не более 2% NH3. Для обеспечения равномерной работы аппарата полезно покрыть резервуар слоем асбеста.
2. Если нужно получить NH3 без примеси пиридиновых оснований*3, то к исходному водному аммиаку прибавляют 1% KMnO4 и полученную мутную жидкость, не отфильтровывая осадка, используют для получения NH3 по п. 1.
3. Смешивают в колбе 5 вес. ч. измельченного NH4Cl с 7 вес. ч. технической свежегашеной извести. К смеси добавляют 10 вес. ч. воды и хорошо перемешивают. При нагревании колбы на песчаной бане получается равномерная струя газа, который пропускают через склянку Тищенко с небольшим количеством воды и осушают твердым KOH. Вместо NH4Cl можно использовать (NH4)2SO4, а вместо Ca(OH)2 - KOH или NaOH.
4. Очистить аммиак от кислорода можно по способу, описанному в разд. "Азот", п. 1 и 2. Приготовление водного аммиака 1. Газообразный аммиак пропускают через дистиллированную воду, охлаждаемую льдом. Так как аммиак очень хорошо растворим в воде, то раствор может засосаться в газоподводящую трубку. Поэтому поглощение целесообразно вести в склянке Тищенко и отсоединить газоподводящую трубку, как только будет прекращена подача аммиака.
Если для приготовления газообразного NH3 в качестве исходного продукта использовался технический сернокислый аммоний. То полученный водный аммиак иногда содержит пиридин.
2. Для приготовления водного раствора аммиака, не содержащего CO2, в плоскодонную колбу емкостью 1 л, снабженную холодильником, наливают 500 мл NH4OH (пл. 0,91), добавляют около 10 г свежегашеной извести, закрывают холодильник трубкой с натронной известью и оставляют стоять смесь на сутки, часто помешивая.
Отдельно готовят 300-400 мл воды, не содержащей CO2, для чего свежепрокипяченную дистиллированную воду охлаждают продуванием воздуха, очищенного от CO2. Для освобождения от CO2 воздух предварительно пропускают через концентрированный раствор KOH и натронную известь.
Далее колбу с NH4OH укрепляют на водяной бане так, чтобы холодильник был направлен косо вверх, и соединяют верхний конец холодильника с приемником-колбой, содержащей 300-400 мл воды, свободной от CO2. При нагревании на водяной бане аммиак переходит в приемник и здесь полностью поглощается водой.
3. Небольшие количества водного раствора NH3 высшей чистоты можно получить методом изотермической перегонки*4. На дно эксикатора помещают несколько кусочков KOH или NaOH и приливают 500 мл NH4OH (пл. 0,88), а на фарфоровой сетке устанавливают большую платиновую или полиэтиленовую чашку с 250 мл бидистиллированной воды. Эксикатор закрывают крышкой и оставляют на 4-5 суток. В чашке получается водный аммиак пл. 0,94 (~14,5% NH3).
*1Астахова Е. К., Астахов К. В. ЖФХ, 1962, т. 36, №11, с. 2570.
*2Попов М. А. ЖПХ, 1938, т. 11, с. 1238.
*3Примесь пиридиновых оснований может содержаться в аммиаке, полученном из коксового газа.
*4Коренман И. К. Количественный микрохимический анализ. М., Госхимиздат, 1949. 320 с. См. с. 18.
| |


