
   |
|
КНИГИ ПО ХИМИИ: |
|
АЗОТ ОКИСЬ
NO Мол. в. 30,01
Свойства
Бесцветный газ. Т. пл. -163,7, т. кип. -151,8 °C. При нормальных условиях 1 л NO весит 1,3402 г. Мало растворим в воде (7,38 мл в 100 г воды при 0 °C), в этиловом спирте - несколько лучше. NO с кислородом образует бурые пары NO2. Для окиси азота, молекула которой имеет неспаренный электрон, вообще характерна способность к реакциям присоединения. Приготовление 1. Окись азота удобно получать взаимодействием металлической меди с разбавленной азотной кислотой:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
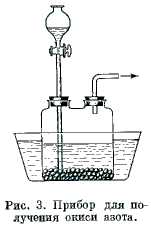 Обрезки меди (проволока, стружка) помещают в двугорлую склянку (рис. 3) или аппарат Киппа и из капельной воронки медленно приливают HNO3 (пл. 1,10-1,15). Не следует допускать заметного разогревания смеси во избежание образования других окислов азота. Поэтому рекомендуется охлаждать реакционную склянку холодной водой. Сначала в склянке появляются бурые пары двуокиси азота, образующегося при окислении NO кислородом воздуха.
Для очистки от высших окислов азота и брызг HNO3 окись азота пропускают через промывную склянку с 5%-ным раствором NaOH и собирают над водой. При необходимости газ сушат, пропуская через трубку с твердым KOH.
2. Окись азота можно получить при нагревании смеси нитрита, нитрата и окиси хрома:
3KNO2 + KNO3 + Cr2O3 = 2K2CrO4 + 4NO
Смешивают 64 г KNO2, 25 г KNO3, 76 г Cr2O3, 120 г Fe2O3 (Fe2O3 добавляют для устранения вспенивания и разбрызгивания) с небольшим количеством воды до образования плотной пасты, прессуют ее в таблетки диаметром 25 мм и сушат*1. При нагревании в пробирке из тугоплавкого стекла 10 г таких таблеток получается 860-870 мл газа, содержащего 99,78% NO.
3. Очень равномерная струя окиси азота получается при приливании из капельной воронки 40%-ного раствора NaNO2 к 30%-ному раствору FeCl2 (или к 20%-ному раствору FeSO4), смешанному с равным объемом соляной кислоты (пл. 1,19):
FeCl2 + NaNO2 + 2HCl = FeCl3 + NaCl + NO + H2O
Выделяющуюся окись азота очищают, пропуская ее последовательно через 10%-ный раствор NaOH. Реакцию удобно проводить в приборе, описанном в п. 1 (охлаждение двугорлой склянки в этом случае не требуется).
*1Ray J. D., Ogg R. A. J. Am. Chem. Soc., 1956, v. 78, №23, p. 5993
| |


