
   |
|
КНИГИ ПО ХИМИИ: |
|
АЗОТ ДВУОКИСЬ И ЧЕТЫРЕХОКИСЬ
NO2 Мол. в. 46,01
N2O4 Мол. в. 92,01
Свойства
Как самостоятельное химическое соединение NO2 (бурый газ) существует только при температуре выше 290 °С. При комнатной температуре имеет место равновесная смесь NO2 и N2O4, представляющая собой красно-бурый газ с резким запахом. Равновесие N2O4
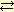 2NO2 зависит от температуры. Ниже 0 °С существует почти исключительно N2O4, поэтому при охлаждении смеси NO2 и N2O4 окраска светлеет. 2NO2 зависит от температуры. Ниже 0 °С существует почти исключительно N2O4, поэтому при охлаждении смеси NO2 и N2O4 окраска светлеет.Четырехокись азота представляет собой бесцветные кристаллы. Т. пл. -9,3, т. кип. 20,7 °С (частично разлагается на NO2). Пл. 1,491 при 0 °С. С небольшим количеством воды образует ярко-зеленый раствор содержащий HNO3, HNO2 и N2O4. При разбавлении раствор обесцвечивается вследствие гидролиза N2O4: N2O4 + H2O = HNO3 + HNO2.
N2O4 - очень слабый окислитель, со многими органическими соединениями реагирует бурно, иногда со взрывом.
Двуокись и четырехокись азота чрезвычайно ядовиты. Пары N2O4 (следовательно, и NO2) удушливы, вызывают кашель, а при длительном вдыхании - воспаление легких. Приготовление 1. Двуокись азота можно получить термическим разложением азотнокислого свинца:
2Pb(NO3)2 = 4NO2б + 2PbO + O2б
Тонко растертый реактив высушивают, нагревая в фарфоровой чашке при перемешивании до момента, когда прекратиться потрескивание и начнется выделение бурого газа. Высушенный Pb(NO3)2 охлаждают в эксикаторе, смешивают с равным весовым количеством предварительно прокаленного кварцевого песка и смесь переносят в реторту. Горло реторты, поднятое вверх, соединяют "встык" с отводной трубкой*1 осушительной колонки, заполненной прокаленным CaCl2. Осушительную колонку соединяют с сухим приемником, на отвод которого надевают хлоркальциевую трубку. Приемник охлаждают смесью льда и поваренной соли.
Реторту со смесью Pb(NO3)2 и песка осторожно нагревают. Выделяющаяся при разложении азотнокислого свинца красно-бурая двуокись азота сгущается в приемнике в зеленоватую жидкость (окраска обусловлена образованием небольших количеств N2O3). Через некоторое время жидкость становится желто-бурой, затем желтой и, наконец, почти бесцветной. При сильном охлаждении жидкость затвердевает в белую кристаллическую массу (твердый N2O4).
Разложение Pb(NO3)2 можно проводить в токе высушенного кислорода (~20 л/ч).
2. Для получения сравнительно больших количеств чистой N2O4 можно использовать реакцию:
2HNO3 + 2NaNO2 = 2NaNO3 + N2O3 + H2O
с последующим окислением N2O3 кислородом*2.
*1Лучше всего соединять части прибора с помощью шлифов или спаивать, не рекомендуется использовать для соединения резиновые трубки. Вместо реторты можно воспользоваться стеклянной трубкой, нагреваемой в трубчатой печи до 300 °С.
*2Иошпа И. Е. и Спиридонова О. П. ЖПХ, 1939, т. 12, №6, с. 951.
| |


