
   |
|
КНИГИ ПО ХИМИИ: |
|
КИСЛОРОД
O2 Мол. в. 31,999
Свойства Бесцветный газ без запаха и вкуса. При нормальных условиях 1 л O2 весит 1,42895 г. Пл. газа (по воздуху) 1,1053. Пл. жидкого кислорода 1,158 г/см3 (при -186 °С). Т. пл. -218,8, т. кип. -182,97 °С. Очень мало растворим в воде (0,031 объема в 1 объеме воды при 20 °С).
Кислород быстро поглощается щелочным раствором пирогаллола и кислыми растворами солей двухвалентного хрома. Расплавленное серебро растворяет почти 10 объемов O2, выделяя его при затвердевании.
Кислород энергично поддерживает горение, поэтому в атмосфере чистого O2 горят такие вещества, которые не удается зажечь на воздухе (железо и др.).
Приготовление 1. Небольшие количества кислорода удобнее всего получать термическим разложением KClO3 в присутствии катализатора (MnO2 или Fe2O3):
2KClO3 = 2KCl + 3O2б
KClO3 и катализатор не должен содержать примеси горючих веществ (уголь, бумага и т. д.), возможен сильный взрыв! Полезно предварительно прокалить небольшую порцию реакционной смеси в металлической ложке, чтобы убедиться, что кислород выделяется спокойно (незначительные искорки, появляющиеся в смеси не представляют опастности).
Смесь из 1 вес. ч. KClO3 и 0,5 вес. ч. катализатора загружают в большую пробирку или колбочку и нагревают горелкой. Выделяющийся кислород может содержать незначительную примесь хлора, от которого его легко очистить, пропуская газ через раствор KOH.
2. Препарат можно получить также при термическом разложении перманганата калия:
2KMnO4 = K2MnO4 + MnO2 + O2б
Нагревание проводят аналогично KClO3 (см. п. 1).
Если необходимо получить кислород, не содержащий даже следов азота и инертных газов, то рекомендуется предварительно нагреть KMnO4 в вакууме при 120 °С для удаления адсорбированных газов, затем отключить вакуумный насос и повысить температуру до начала разложения KMnO4. Из 318 г KMnO4 получается 17 л чистого кислорода.
3. Кислород можно получить путем каталитического разложения перекиси водорода:
2H2O2 = 2H2O + O2б
Грубо измельченную MnO2 (ч.) отсевают от пыли и помещают в средний шар аппарата Киппа на подостланный волокнистый асбест. Аппарат заполняют раствором, который готовят, прибавляя при охлаждении 150 мл H2SO4 (пл. 1,84) к 1 л 3%-ной H2O2. Выделяющийся кислород довольно чист. При работе с малыми количествами вместо аппарата Киппа можно использовать колбу Эрленмейера.
4. Чистый кислород можно получить также по методике, основанной на каталитическом разложении H2O2 при погружении в реакционный раствор платинированной никелевой пластинки*1; меняя глубину погружения, можно регулировать скорость разложения. Пластинку предварительно прокаливают в токе водорода до светло-серого цвета поверхности.
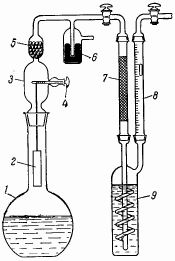 Процесс рекомендуется проводить в приборе, схема которого изображена на рис. 24. К реакционной колбе 1 емкостью 500 мл присоединяют насадку 3 со стеклянной поворачивающейся на шлифе пробкой-ворот 4. К этой пробке на тонкой (0,1 мм) платиновой проволоке подвешивают платинированную никелевую пластинке 2, свернутую в цилиндр. Вращая пробку 4, можно погружать пластинку в реакционный раствор на большую или меньшую глубину. Колбу заполняют 30%-ной перекисью водорода (техн.). Первые порции кислорода загрязнены воздухом, поэтому их отбрасывают. Далее выделяется очень чистый газ, содержащий лишь брызги H2O2. Для очистки газ пропускают через трубку 5, заполненную стеклянными бусами, и через платинированную медную сетку 7. Сушат газ в промывной склянке 9 с конц. H2SO4. Реакция прекращается, когда концентрация H2O2 упадет до 1,5%.
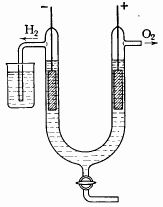 5. Чистый свободный от азота кислород, можно получить электролизом растворов щелочей или кислородных кислот. Электролиз рекомендуется проводить в стеклянной U-образной трубке*2 (рис. 25) внутренним диаметром 40-50 мм с цилиндрическими из никелевой жести или лучше из платины электродами при напряжении 10 В. Электролитом может служить 30%-ный раствор NaOH, 20%-ная H2SO4 (при использовании платиновых электродов), 20%-ный раствор CrO3 в 10%-ной H2SO4 или насыщенный раствор KMnO4 в 10%-ной H2SO4.
Если кислород должен выходить из прибора под давлением более 20-30 мм вод. ст, то трубку, отводящую водород погружают на некоторую глубину в стакан с водой, чтобы создать равное давление во втором колене прибора.
Для очистки выделяющийся кислород пропускают через стеклянную вату для удерживания брызг, затем через нагретый до 400 °С платинированный асбест для контактного окисления следов водорода. Если применяют никелевые электроды, покрытые слоем черной NiO, то выделяющийся кислород не содержит H2.
Этот же прибор может применяться для получения H2.
При повторном пользовании прибором следует особо внимательно проверить, на перепутаны ли полюса.
6. Продажный сжатый кислород (в стальных баллонах) достаточно чист и его можно применять для большинства лабораторных работ. Полезно промывать его растворами KMnO4, KOH и конц. H2SO4. Примесь N2 обычно не мешает.
*1Для патинирования никелевую пластинку опускают в 1-2%-ный раствор H2[PtCl6] и присоединяют к отрицательному полюсу аккумулятора напряжением 4 В. В качестве анода используют кусок платиновой проволоки. Через 10-15 мин пластинку вынимают из электролита и промывают водой.
|


