
   |
|
КНИГИ ПО ХИМИИ: |
|
|
Ацилированием называют реакции замещения водорода спиртовой или аминогруппы на остаток карбоновой кислоты, или ацил
 . В результате ацилирования спиртов получают сложные эфиры, при ацилировании аминов - одно- и двузамещенные амиды. . В результате ацилирования спиртов получают сложные эфиры, при ацилировании аминов - одно- и двузамещенные амиды. Ацилирование можно проводить различными методами; наиболее часто применяют следующее:
1. Непосредственное нагревание спирта или амина с органической кислотой:
  2. Реакция обратима и не доходит до конца, если не принять меры к связыванию или удалению образующейся при реакции воды. Ацилирование спиртов может быть значительно облегчено прибавлением концентрированной серной кислоты или введением безводного хлористого водорода, которые не только связывают выделяющуюся при реакции воду, но также каталитически ускоряют процесс. Однако многие органические вещества претерпевают глубокие изменения в присутствии концентрированных минеральных кислот, и поэтому данный способ имеет лишь ограниченное применение.
2. Нагревание спирта или амина с ангидридом кислоты:
  Образования воды в этом случае не происходит и реакция идет в отсутствие водуотнимающих средств, вроде серной кислоты. Поэтому данный способ является более общеприменимым.
3. Действие на спирт или амин хлорангидрида кислоты:
  Вследствие большой реакционной способности хлорангидридов реакция протекает весьма энергично; она широко применяется как в лабораторной практике, так и в технике. Прибавляя щелочь, можно связать выделяющуюся соляную кислоту и тем самым избежать, если это необходимо, нежелательного воздействия минеральной кислоты.
Уксусноэтиловый эфир получается при нагревании уксусной кислоты с этиловым спиртом в присутствии концентрированной серной кислоты:
 Серная кислота (точнее - ионы водорода, образующиеся при ее диссоциации) каталитически ускоряют процесс, а кроме того, являясь водуотнимающим средством, она способствует более полному протеканию реакции. (Серная кислота как катализатор этого процесса предложена В. В. Марковниковым в 1873 г.)
Реакция этерификации обратима*1; поэтому при проведении ее обычно приходится принимать меры к тому, чтобы сместить равновесие в нужном направлении. В данном случае, так как уксусноэтиловый эфир легколетуч, то отгонка его из реакционной смеси по мере его образования обуславливает смещение равновесия рассматриваемой реакции вправо и практически полное его протекание.
Вместе с уксусноэтиловым эфиром отгоняется некоторое количество спирта; поэтому спирт приходится брать в избытке и выход продукта рассчитывать на взятое количество уксусной кислоты. Вследствие неизбежных потерь эфира в процессе его очистке (в силу его летучести и хорошей растворимости в воде) практический выход обычно не превышает 70% от теоретического.
Реактивы: В перегонную колбу емкостью 100 мл помещают 15 мл спирта и затем осторожно при перемешивании приливают такой же объем концентрированной серной кислоты. Колбу закрывают пробкой, в которую вставлена капельная воронка, соединяют с длинным холодильником и нагревают на масляной бане до 140°. Нагревание можно вести и на сетке, но в этом случае в пробку нужно вставить термометр, опустив шарик его в жидкость; нагревать следует до 110-120°.
В нагретую смесь постепенно приливают из капельной воронки смесь 30 мл спирта и 30 мл ледяной уксусной кислоты. Приливание ведут с такой же скоростью, с какой отгоняется образующийся эфир. По окончании реакции дистиллят (для удаления уксусной кислоты) взбалтывают с насыщенным раствором углекислого натрия до тех пор, пока синяя лакмусовая бумажка, опущенная в верхний слой эфира, не перестанет краснеть. Раствор углекислого натрия нужно прибавлять постепенно, так как жидкость сильно вспенивается выделяющимся углекислым газом. Смесь переливают в делительную воронку, отделяют эфир от нижнего водного слоя и для освобождения от примесей спирта взбалтывают его с 15 мл 50%-ного раствора хлористого кальция. Отделив эфир, его сушат безводным сернокислым натрием и перегоняют на водяной бане из маленькой перегонной колбы.
Выход около 30 г.
Темп. кип. 77,2°.
Препарат может быть использован для синтеза ацетоуксусного эфира.
Образование бензойноэтилового эфира протекает согласно уравнению:
 Как и в случае получения уксусноэтилового эфира, для ускорения реакции прибавляют серную кислоту. Так как бензойноэтиловый эфир труднолетуч, то для смещения равновесия вправо приходится прибавлять большой избыток спирта.
Реактивы: В круглодонную колбу емкостью 100-150 мл помещают смесь исходных продуктов, прибавляют 4 мл концентрированной серной кислоты и бросают несколько кусочков пористой глиняной тарелки. Смесь нагревают в течение 3 час. на водяной бане с обратным холодильником. Затем заменяют обратный холодильник нисходящим и по возможности полно отгоняют избыток спирта. Остаток после охлаждения выливают в 80 мл холодной воды и нейтрализуют твердым углекислым натрием.
Выделившееся масло извлекают эфиром, отделяют при помощи делительной воронки эфирный слой и сушат его в течение нескольких часов хлористым кальцием. Затем переливают раствор в небольшую перегонную колбу, бросают в нее несколько стеклянных капилляров и отгоняют эфир на водяной бане. Оставшийся в колбе бензойноэтиловый эфир перегоняют на небольшом пламени (без сетки) с воздушным холодильником.
Выход 10-12 г.
Темп. кип. 212,9°; уд. вес
 1,0509; показатель преломления 1,0509; показатель преломления 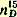 1,5079. 1,5079.
Образование щавелевоэтилового эфира протекает согласно уравнению:
 Щавелевая кислота при нагревании с серной кислотой разлагается, образую в числе продуктов разложения углекислый газ, окись углерода и муравьиную кислоту. Поэтому при получении щавелевоэтилового эфира путем нагревания щавелевой кислоты со спиртом и серной кислотой выходы получаются недостаточно хорошие. Лучшие результаты получают, проводя реакцию при низких температурах и заменяя серную кислоту безводным хлористым водородом.
Реактивы: Продажная кристаллическая щавелевая кислота содержит две молекулы кристаллизационной воды. Для обезвоживания ее растирают в порошок, рассыпают тонким слоем на листах фильтровальной бумаги и высушивают в течение нескольких часов в сушильном шкафу при 95°.
Отвешенное количество безводной щавелевой кислоты помещают в круглодонную колбу емкостью 150-200 мл, приливают спирт и при помощи двурогой насадки присоединяют обратный холодильник, как показано на рис. 29. Верхний конец холодильника закрывают хлоркальциевой трубкой (см. рис. 41).
Через стеклянную трубку, доходящую почти до дна колбы, пропускают сильную струю хлористого водорода. Реакционная смесь при этом разогревается, и после 10-минутного пропускания хлористого водорода ее охлаждают до 0°; хлористый водород продолжают пропускать до тех пор, пока он не перестанет поглощаться и не начнет выходить через хлоркальциевую трубку. Тогда постепенно, при перемешивании, выливают продукт реакции в смесь 300 г толченого льда и 200 г измельченного кристаллического углекислого натрия. Выделившийся эфир отделяют при помощи делительной воронки, промывают небольшим количеством воды, сушат хлористым кальцием и перегоняют из небольшой перегонной колбы с воздушным холодильником.
Выход 26-28 г.
Темп. кип. 186°.
Полученный препарат может быть использован для синтеза щавелевоуксусного эфира.
Ацетилирование (т. е. замещение водорода на остаток уксусной кислоты - ацетил) анилина производят или нагревая его с избытком ледяной уксусной кислоты, или (что более удобно) путем взаимодействия анилина с уксусным ангидридом:
 Реактивы: В литровом стакане к 500 мл воды приливают 17 мл концентрированной соляной кислоты и при помешивании прибавляют анилин. Если раствор получается окрашенным, то прибавляют 3-4 г активного угля, перемешивают в течение 5 мин. и фильтруют. Бесцветный раствор нагревают до 50°, приливают уксусный ангидрид и перемешивают до полного его растворения. Затем немедленно приливают раствор 30 г уксуснокислого натрия в 100 мл воды, хорошо перемешивают и охлаждают льдом. Выпавшие кристаллы ацетанилида отфильтровывают на воронке Бюхнера, отсасывают и промывают небольшим количеством ледяной воды. Продукт получается достаточно чистым; в случае необходимости его можно перекристаллизовать из воды.
Выход 21-22 г.
Темп. пл. 115°.
Препарат может быть использован для получения п-нитроанилина.
Примеры ацилирования посредством хлорангидрида кислоты в присутствии щелочи были приведены ранее (см. 10. Хлористый бензоил и 11. Хлористый п-нитробензоил).
В некоторых случаях бензоилирование протекает более гладко, если водный раствор щелочи заменить пиридином, который является хорошим растворителем для большинства органических соединений. В качестве промежуточного продукта при этом образуется бензоилпиридинийхлорид, отличающийся большой реакционной способностью:
 Бензоилпиридинийхлорид при взаимодействии со спиртами образует солянокислый пиридин и соответствующий бензойный эфир:
 В присутствии воды бензоилпиридинийхлорид образует бензойный ангидрид, который может загрязнять основной продукт реакции:
 Примером бензоилирования в присутствии пиридина может служить получение глицеринтрибензоата:
 Реактивы: В конической колбе смешивают глицерин с 9 мл чистого пиридина и к охлаждаемому льдом раствору понемногу прибавляют хлористый бензоил.
Из раствора, принимающего красную окраску, выпадает обильный осадок солянокислого пиридина. Смесь оставляют стоять несколько часов и затем прибавляют холодную разбавленную (10%) серную кислоту. Солянокислый пиридин при этом растворяется, а трибензоат глицерина выпадает в виде осадка, который отсасывают, хорошо промывая водой, высушивают и перекристаллизовывают из спирта.
Выход около 6 г.
Темп. пл. 76°.
*1Равновесный характер и кинетика реакции этерификации изучены Н. А. Меншуткиным. Установлено, что с наибольшей скоростью протекает реакция этерификации первичных спиртов, с наименьшей - третичных. Аналогичные соотношения скоростей реакции этерификации наблюдаются у кислот, содержащих карбоксильную группу при различных атомах углерода (первичном, вторичном или третичном).
|



